
- 食欲を支配する 脂細胞・胃・腸内細菌 の 連携
- 白色脂肪細胞「満腹シグナル」のメカニズム
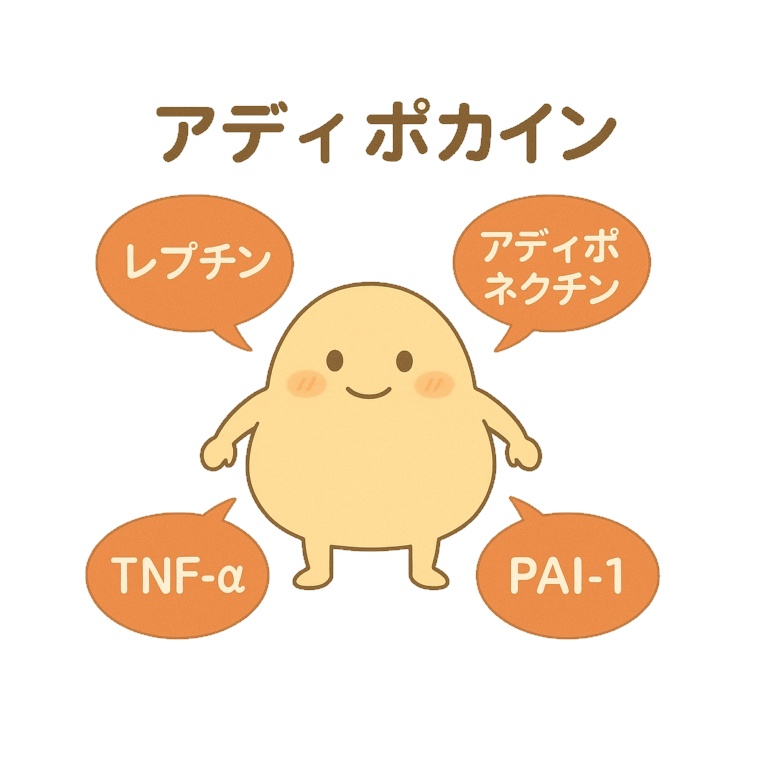
- 「白色脂肪細胞」から分泌される代表的な「アディポカイン」
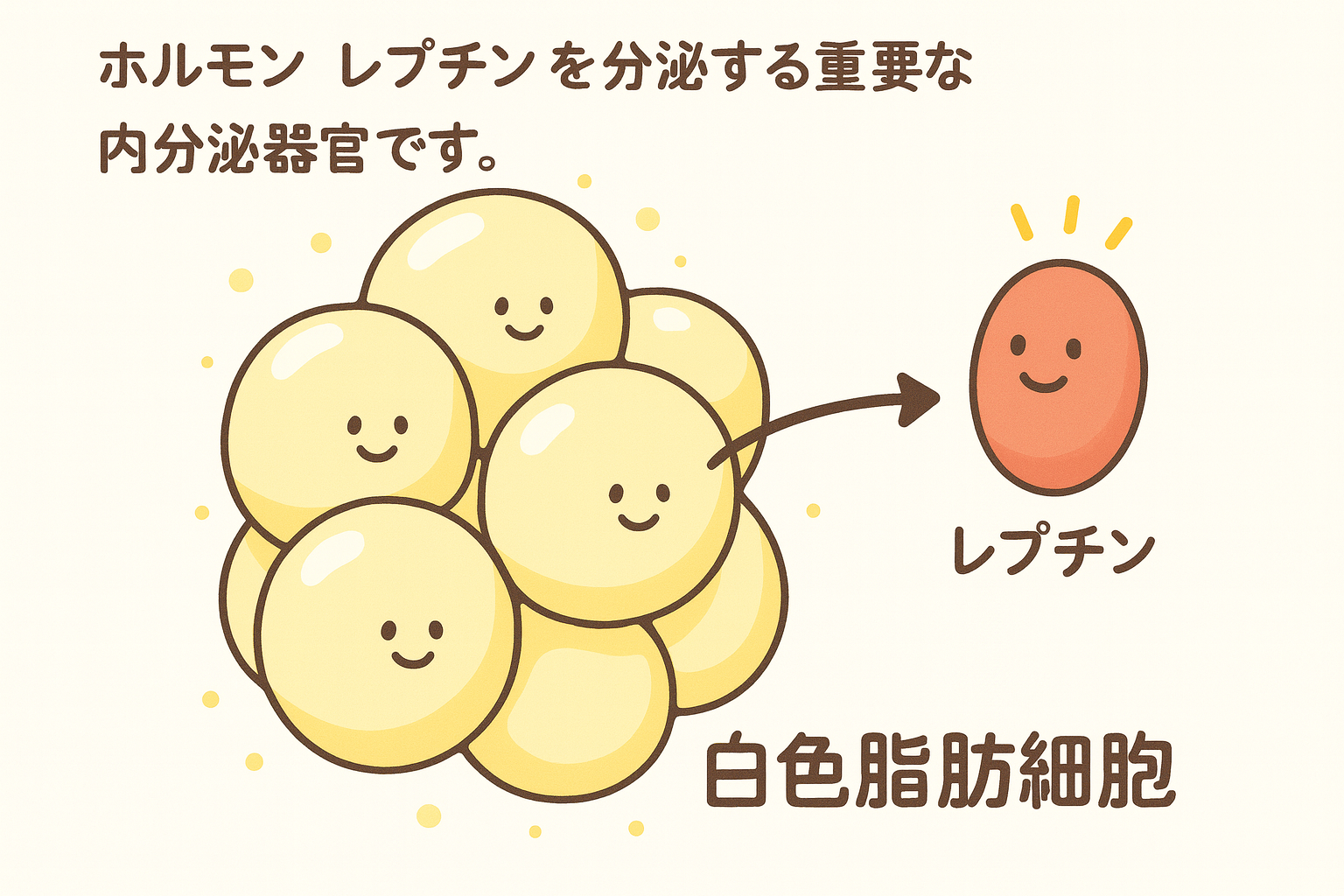
- 「レプチン」が脳に伝える満腹のシグナル
- 「胃」から分泌される空腹ホルモン 「グレリン」
- ■「腸内マイクロバイオータ」が生み出す「第三の食欲システム」
- ■「食物繊維」をごはんにして働く「腸内細菌」
食欲を支配する 脂細胞・胃・腸内細菌 の 連携
近年の研究によって、肥満は単なる
「食べすぎや運動不足」だけで
説明できないことが明らかになってきました。
背景には
・ ・
という 三重のシステム が存在し、
それぞれが 脳の 視床下部 に情報を送ることで食欲 を制御しています。
👇👇👇👇👇👇
過食 や 肥満 へと つながるのです。
白色脂肪細胞「満腹シグナル」のメカニズム
は、
体脂肪の 主役 となる 脂肪細胞 で、私たちの体内に最も多く存在します。
皮下脂肪 や 内臓脂肪 の 中にびっしりと詰まっており、
エネルギー を ためる細胞 =「倉庫」のような働きをしています。
👇👇👇👇👇👇
余剰のブドウ糖や脂肪酸を取り込み、 中性脂肪に変えて蓄える。
空腹や運動などでエネルギーが必要になると、蓄えた脂肪を脂肪酸とグリセロールに分解し、血中に放出する。
細胞 の 内部には 脂肪滴 と呼ばれる大きな
脂質の塊があり、余分な ブドウ糖 や 脂肪酸 を取り込み、
「中性脂肪」として蓄えます。
白色脂肪細胞 の内部にある 脂肪 そのものの 塊です。
白色脂肪細胞 の 中では、この脂肪滴がほぼ全体を占めており、
脂肪をためる「タンク」 や 「燃料のドラム缶」 にあたります。
そして、 飢餓状態 や 運動時 には この「脂肪」を 分解して
エネルギー源として利用できるのです。
白色脂肪細胞 は単なる エネルギー貯蔵庫 だけでなく
内分泌臓器 として 全身の 代謝恒常性 を制御する
「中枢的役割」を担うことが明らかになっています。

白色脂肪細胞から分泌される
多様な 生理活性物質 は
アディポカインと総称され、
「代謝」「食欲」「炎症」
さらには「心血管機能」にまで影響を及ぼします。
「白色脂肪細胞」から分泌される代表的な「アディポカイン」
には、
「アディポネクチン」「レプチン」「TNF-α」「PAI-1」「IL-6」
などがあります。
「アディポネクチンとレプチン」は
インスリン感受性の亢進や食欲抑制などに関わる
アディポカインの一種「レプチン」
レプチンは 脂肪細胞 から 分泌される ホルモン
脂肪量 に 比例して 分泌され、
視床下部 にある 弓状核 に 作用することで
食欲抑制シグナル を伝達し、エネルギー消費を促進します。
ただし 肥満状態では レプチン抵抗性 が生じ、作用が 減弱します。
アディポカインの一種「アディポネクチン」
アディポネクチンは 脂肪細胞 から分泌される ホルモン
インスリン感受性 を 増強し、
骨格筋 での 糖 取り込み や 脂肪酸酸化 を促進します。
さらに 抗炎症作用・抗動脈硬化作用 を持ち
「肥満や2型糖尿病 患者」ではその血中濃度が低下します。
アディポカインの一種「炎症性サイトカイン」
炎症性サイトカイン(TNF-α, IL-6など)は
炎症反応 を 促進する タンパク質性の 信号分子
脂肪組織の 肥大に伴い 分泌が増加し、慢性的炎症環境 を形成。
これにより インスリン抵抗性 を惹起し、
メタボリックシンドローム や 糖尿病の「病態形成」に寄与します。
白色脂肪細胞は「ホルモン分泌工場」
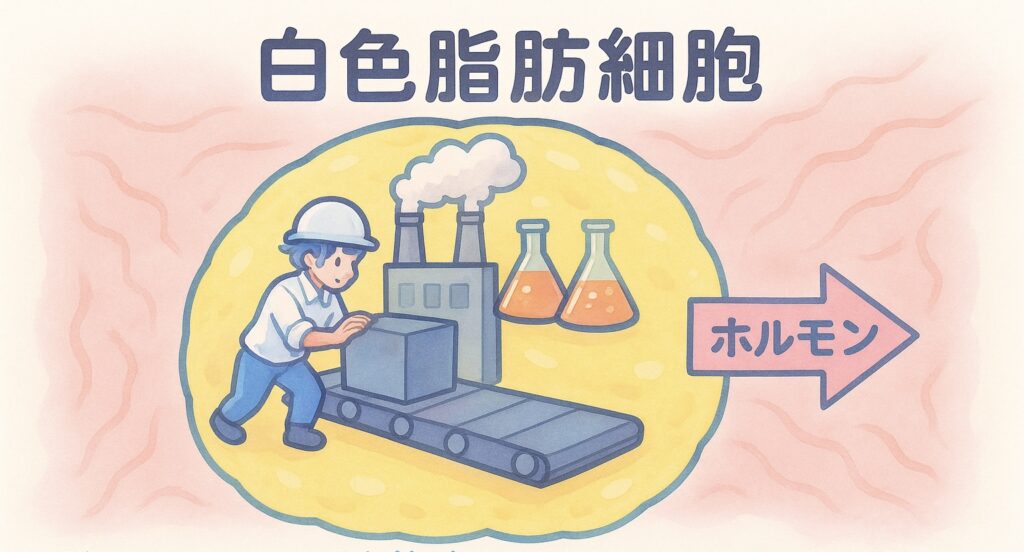
つまり 白色脂肪細胞 は
単なる脂肪の「貯蔵庫」ではなく、全身の「代謝 や 食欲」を制御する
ホルモン分泌工場 でもあるのです。
「レプチン」が脳に伝える満腹のシグナル
私たちの体には、食べすぎを防ぎ、エネルギーのバランスを保つための
その中心的な役割を担うのが、脂肪細胞から分泌されるホルモン
👇👇👇👇👇👇
レプチンは 血液を流れて 「血液脳関門(BBB)」を通過し、
脳の「視床下部」に到達します。
食欲・体温・睡眠・ホルモン分泌など、 生命維持の根幹を司る重要なエリアです。
その中にある 弓状核が、食欲コントロールの 最前線。
ここには「食べる神経」と「やめる神経」が共存しています。
👇👇👇👇👇👇👇👇👇👇
| 神経群 | 働き | 状況 |
|---|---|---|
| POMCニューロン | 食欲を抑える(抑制系) | 食後(レプチンが高い時) |
| NPY/AgRPニューロン | 食欲を高める(促進系) | 空腹時(レプチンが低い時) |
レプチンがまず働きかけるのは、食欲を抑える神経群
食欲を抑える神経群であるPOMCニューロン から分泌されるのが
👇👇👇👇👇
です。
α-MSH(アルファ・メラニン細胞刺激ホルモン)は
脳内の メラノコルチン受容体に結合し、
「もう十分食べた」という満腹感を強化するシグナルを発生させます。
このシグナルが届くと、
👇👇👇👇👇👇👇👇👇👇
- 食欲が自然に落ちる
- エネルギー消費が高まる
- 体温や代謝が安定する
といった反応が起こります。
| 流れのまとめ | 内容 |
|---|---|
| ステップ ① | 脂肪細胞がレプチンを分泌 |
| ステップ ② | レプチンが脳(視床下部・弓状核)に届く |
| ステップ ③ | POMCニューロンを刺激 → α-MSH放出 → 満腹感アップ |
| ステップ ④ | NPY/AgRPニューロンを抑制 → 空腹感ダウン |
| ステップ ⑤ | 代謝・体温・感情バランスも調整 |
α-MSHの働きは「食欲抑制」だけではありません。
実は、全身の生理反応にも多面的に関与しています。
👇👇👇👇👇👇
- 皮膚:メラニン色素の生成を促進(肌の色調を調整)
- 自律神経系:体温を上げ、代謝を活性化
- 脳内:情動・性的興奮・快感・ストレス緩和にも関与
つまり、レプチンの情報は単なる「満腹サイン」ではなく、
代謝や感情のバランスを取る包括的な信号でもあるのです。
弓状核にはPOMCニューロンともう一つ
という
「空腹を感じさせる神経群」もあります。
これは空腹時に活性化し、「食べたい!」という衝動を生み出します。
ところがレプチンは、この神経群の活動を直接抑制。
つまり、「食べるスイッチ」をOFFにしながら、「やめるスイッチ」をONにする――
レプチンは二重のブレーキ機構で食欲を制御しているのです。
肥満が進むと
血中レプチンは高いままなのに脳が反応しなくなることがあります。
これがす。
👇👇👇👇👇👇主な原因は:👇👇👇👇👇👇
- 慢性的な高脂肪食・高カロリー食
- 慢性炎症
- 睡眠不足・ストレス
- 血液脳関門の機能低下
その結果、脳は「まだ足りない」と勘違いし、
過食や代謝低下を招き、さらに脂肪が増えるという悪循環に陥ります。
「胃」から分泌される空腹ホルモン 「グレリン」
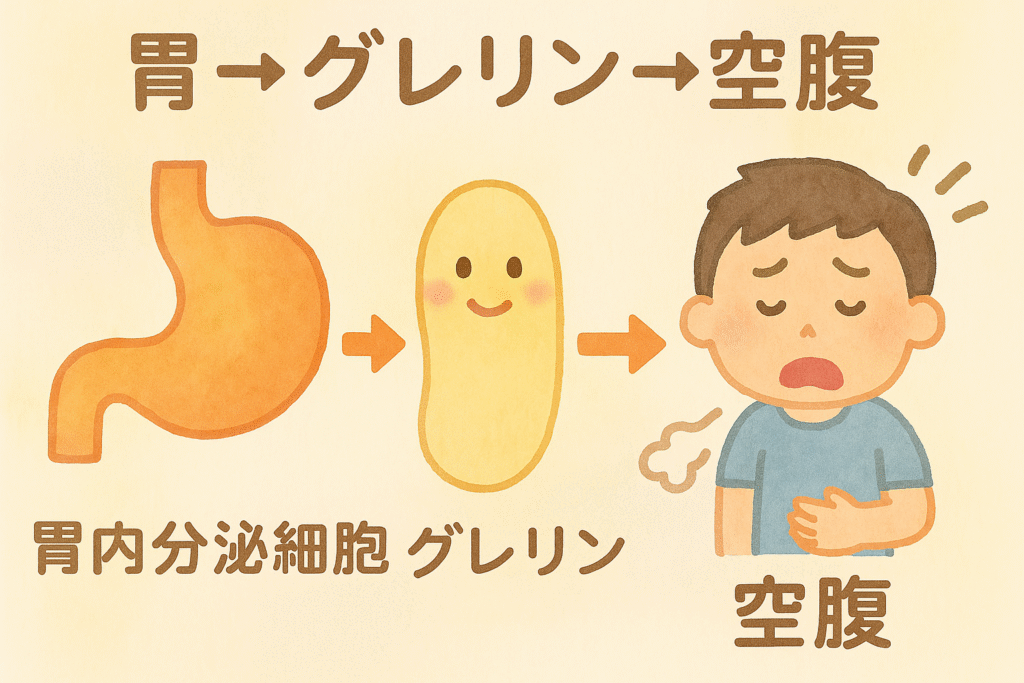
「空腹」になると「胃」の「粘膜」にある
「内分泌細胞」から
「グレリン」という「ペプチドホルモン」が分泌されます。
「グレリン」は
「弓状核」の「食欲促進ニューロン」を直接刺激し、
「脳」に「今こそ食べるべきだ」という「信号」を送ります。
この働きによって、「体」は「エネルギー不足」を
素早く検知し、「摂食行動」を誘発します。
特に「グレリン」は、
「食欲増進作用」に加えて「成長ホルモン」の「分泌促進作用」も持つことから、
「エネルギーバランス」全体を調整する重要な「ホルモン」といえます。
■「腸内マイクロバイオータ」が生み出す「第三の食欲システム」
私たちの「食欲」は、
「脂肪細胞」が分泌する「レプチン」や「胃」から分泌される「グレリン」
などによってコントロールされています。
しかし近年、それとは異なる新しい調節経路
「腸内マイクロバイオータ」による「短鎖脂肪酸」シグナルが明らかになってきました。
「腸内細菌」が作る「短鎖脂肪酸」は、単なる「腸内発酵」の副産物ではなく、
「受容体」・「ホルモン」・「神経経路」
を介して全身に「シグナル」を伝える「生理的メッセンジャー」です。
この仕組みは「第三の食欲制御システム」
として注目されています。
■「食物繊維」をごはんにして働く「腸内細菌」
1️⃣ 食物繊維を腸内細菌が発酵
↓
2️⃣ 短鎖脂肪酸(酢酸・プロピオン酸・酪酸)が作られる
人の「消化酵素」では分解できない「食物繊維」や「難消化性多糖類」は、
「小腸」で吸収されずにそのまま「大腸」まで届きます。
「大腸」では、そこに常在する多種多様な「腸内マイクロバイオータ」が
これらの「食物繊維」を「発酵」によって分解します。
この「発酵」の過程で「短鎖脂肪酸」という「物質」を作ります。
この「短鎖脂肪酸」には主に3種類あります。
「 酢酸(C2)」「プロピオン酸(C3)」「酪酸(C4)」
| 名称 | 炭素数 | 主な働き |
|---|---|---|
| 酢酸(C2) | 2 | 全身へ運ばれ、脂質代謝や血圧を調整 |
| プロピオン酸(C3) | 3 | 肝臓で糖新生の材料となり、血糖値を安定化 |
| 酪酸(C4) | 4 | 大腸上皮のエネルギー源となり、腸バリアを強化 |
「短鎖脂肪酸」は「腸から出るメッセンジャー」
これらの「短鎖脂肪酸」は、
「腸」の中だけで働くわけではありません。
「血液」や「神経」を通じて全身に届き、
いろんな「臓器」に 「今、食べ物が入ってきたよ!」 という信号を送ります。
「腸内細菌」が「食物繊維」を発酵して作る
「短鎖脂肪酸」は、
「大腸上皮細胞」の主要な「エネルギー源」として働きます。
これにより、
「腸粘膜」は「エネルギー」を得て「粘液分泌」を促進し
「水分」・「ミネラル吸収」を助け、「炎症」を抑えて「腸」のバリア機能を保護します。
しかし、その役割は「腸内」だけにとどまりません。
「短鎖脂肪酸」の一部は
「門脈」から「血流」に乗って「肝臓」や全身の組織に運ばれ、
さらには「神経」を介して
「脳」や「自律神経系」にも影響を及ぼします。
つまり、「短鎖脂肪酸」は単なる
「腸内代謝物」ではなく、
「腸」から全身へ情報を伝える「分子メッセンジャー」
「今、食べ物が入ってきた」「栄養状態がこう変化している」といった信号を、
「血液」を通じて➡「臓器」へ、「神経」を通じて➡「脳」へ伝えることで、
全身の
「代謝」・「食欲」・「免疫」・「循環機能」を調整しています。
■「短鎖脂肪酸」は「受容体」に結合して作用する
1️⃣ 食物繊維を腸内細菌が発酵
↓
2️⃣ 短鎖脂肪酸(酢酸・プロピオン酸・酪酸)が作られる
↓
3️⃣ 受容体(GPR41/43・Olfr78)を通じて体に信号
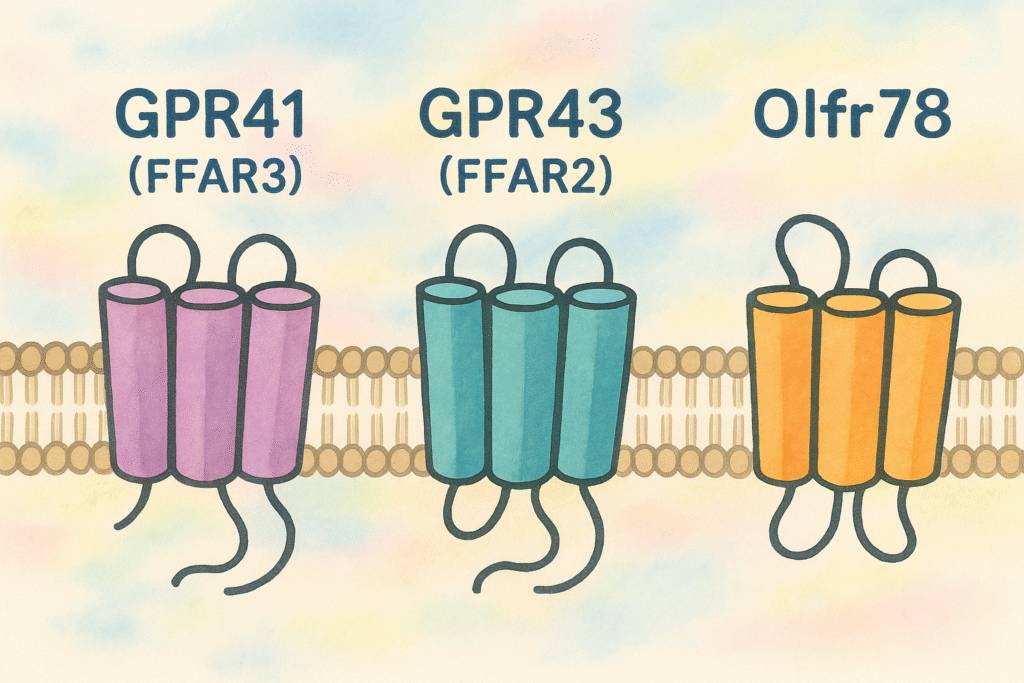
「短鎖脂肪酸」は、私たちの体のさまざまな「臓器」に存在する
「受容体(レセプター)」に結合して作用します。
これらの「受容体」は「Gタンパク質共役型受容体(GPCR)」と呼ばれ、
外部の刺激を感知し、「細胞内」に信号を伝える「翻訳装置」のような存在です。
「短鎖脂肪酸」がこの「受容体」に結合すると、
その情報は「細胞」の内部に伝達され、
「エネルギー代謝」・「ホルモン分泌」・「血圧調整」・「免疫反応」など、
多彩な生理機能のスイッチが入ります。
| 項目 | 内容 |
|---|---|
| 主な短鎖脂肪酸 | 酢酸(C2)、プロピオン酸(C3)、酪酸(C4) |
| 主な受容体 | GPR41(FFAR3)、GPR43(FFAR2)、Olfr78 |
| 受容体の特徴 | 細胞膜上に存在し、外部の刺激を細胞内に伝える「翻訳装置」 |
| 主な作用領域 | 腸、脂肪組織、交感神経節、免疫細胞、肝臓、血管平滑筋など |
| 生理作用 | 代謝調整・ホルモン分泌・血圧制御・免疫制御など |
■GPR41(FFAR3)
「プロピオン酸」と「GPR41」の関係
「短鎖脂肪酸」の中でも プロピオン酸 は、
「小腸」の
「L細胞(腸内分泌細胞)」に多く存在する、「 GPR41受容体(FFAR3)」 を活性化します。
この「GPR41受容体」が「刺激」を受けると、
「L細胞」から「 ペプチドYY(PYY)」 という「ホルモン」が分泌されます。
「 ペプチドYY(PYY)」は「食欲抑制ホルモン」として知られ、
次のように働きます:
「もう食べなくていい」という信号を発して「 食欲」を抑制
「血流」 または 「神経経路(特に迷走神経)」を通じて「脳」へ情報を伝達
「脳」の「視床下部」に到達
■「GPR41」のもう一つの側面 ― 「交感神経」の活性化
「GPR41」は「腸内」だけでなく、
「交感神経節」にも多く発現しています。
研究では、「GPR41遺伝子」を欠損させた「マウス」を用いることで
次の事実が明らかになりました:
| 条件 | 結果 |
|---|---|
| GPR41欠損マウス | ノルアドレナリン分泌が低下、エネルギー消費が減少 |
| 正常マウスにプロピオン酸投与 | ノルアドレナリン増加、心拍数・体温・酸素消費量上昇 |
このことから、「プロピオン酸」が「GPR41」を介して「交感神経」を活性化し、
「エネルギー消費」を高める ことが分かっています。
GPR41の活性化によって起こる2つの主要作用:
- L細胞経路 → PYY分泌 → 食欲抑制
- 交感神経経路 → ノルアドレナリン増加 → エネルギー消費上昇
この二重の作用が、「肥満を防ぐ生理的メカニズム」に寄与していると考えられています。
■GPR43(FFAR2)
「GPR43」は
「酢酸」・「プロピオン酸」・「酪酸」のいずれにも反応し
「皮下脂肪」や「内臓脂肪」の中にある「白色脂肪細胞」に多く存在しています。
「白色脂肪細胞」は、余った「エネルギー」を「中性脂肪(トリグリセリド)」として貯め込む
「倉庫」のような役割を持ちます。
しかし、「酢酸」が「GPR43」に結合すると、この「細胞」の行動は大きく変わります。
「GPR43」が「酢酸」で活性化されたときの「脂肪細胞」と全身代謝の変化
| 脂肪細胞と全身代謝の変化 | 内容 | 作用・結果 |
|---|---|---|
| ① 糖の取り込みをストップ | 酢酸がGPR43を活性化 → 脂肪細胞でのグルコース取り込み抑制 | 「もう十分」と判断して入口を閉じ、余分な糖の蓄積を防ぐ |
| ② 脂肪合成のブレーキ | 糖が入らないことで脂肪合成(リポジェネシス)の材料が不足 | 中性脂肪合成が抑制され、脂肪細胞の肥大化を防ぐ |
| ③ 全身のエネルギー効率を改善 | 取り込まれなかった糖が筋肉・肝臓へ回る | 筋肉での糖利用↑、肝臓代謝効率↑、インスリン感受性↑、全身の代謝が改善 |
このように、「GPR43」は「脂肪をためすぎないように体を守る仕組み」として働いています。
食事をして「腸内」で「酢酸」が増えると、
この「GPR43」が活性化して「脂肪」の合成を抑えます。
一方、「空腹」のときや「酢酸」が少ないときには「GPR43」の働きが弱まり、
今度は「脂肪」を「エネルギー」として使いやすい状態になります。
■「Olfr78」
「GPR41」や「GPR43」は
「腸」や「脂肪組織」で「エネルギー代謝」を調整したり、
「交感神経」を介して「エネルギー消費」を高めたりすることが知られています。
そして近年注目されているのが、
もともとは「嗅覚」を司る「受容体」として知られていた
「Olfr78」です。
「Olfr78」は本来は
「嗅上皮」の「嗅細胞」に発現し、
「オイゲノール」などの匂い分子を感知する「受容体」として知られていた
しかし近年の研究で、
「腎臓」や「腸」などの
「非嗅覚組織」にも発現していることがわかっています。
「腎臓」の「傍糸球体細胞」では、「短鎖脂肪酸」に応答して「レニン分泌」を促進。
その結果、「 レニン-アンジオテンシン系」を介して「血圧」を上昇させる。
「血管平滑筋」でも「酢酸」・「プロピオン酸」刺激によって
「血管収縮」・「拡張反応」を制御。
これにより、
「血圧」や「血流」を一定に保つ「循環動態の恒常性維持」に寄与していると考えられます。
このように、「腸」で生じた「短鎖脂肪酸」が「腎」・「血管機能」に影響を及ぼす
「腸–循環軸」を形成しているのです。
さらに驚くべきことに、
「腸の内分泌細胞(特にL細胞)」にも「Olfr78」がが発現していることが発見されました。
ここで「短鎖脂肪酸(特に酢酸・プロピオン酸)」が「Olfr78」を刺激すると、
「ペプチドYY(PYY)」が分泌されます。
「ペプチドYY(PYY)」は次のように作用します:
視床下部の食欲抑制ニューロン(POMC/CART)を活性化 → 摂食行動を抑える
胃の排出を遅らせる → 消化をゆるやかにし、満腹感を持続
このため、腸内での「短鎖脂肪酸 → Olfr78 → PYY分泌 → 脳満腹中枢」の経路が、
新しい食欲制御システムとして注目されています。
| 受容体 | 主な場所 | 主な働き |
|---|---|---|
| GPR41(FFAR3) | 交感神経節 | 心拍やエネルギー消費を上げて代謝を促す |
| GPR43(FFAR2) | 腸・脂肪組織・免疫細胞 | 満腹ホルモン(GLP-1、PYY)を出したり、炎症を抑えたりする |
| Olfr78 | 腎臓・腸 | 血圧を整えたり、食後の満腹感を長く保つ |
■「長鎖脂肪酸」による「食欲制御」と「肥満抑制」のメカニズム
「長鎖脂肪酸(LCFAs)」は
「炭素数」が12以上の「脂肪酸」を指し、「食事由来脂質」の大部分を占めています。
これまで主に「エネルギー源」として認識されてきましたが、
近年の研究により、
「腸管内分泌細胞」や「神経系」にシグナルを送る「栄養センサー」としての機能を持ち、
「食欲」や「代謝調節」に深く関与していることが明らかになってきました。
「 GPR40(FFAR1)」と「GPR120(FFAR4)」の役割
「腸管」の「L細胞」をはじめ、「膵β細胞」や「脂肪細胞」にも発現する「脂肪酸受容体」が、
「長鎖脂肪酸」のシグナル伝達に重要です。
- GPR40(FFAR1) は中鎖~長鎖脂肪酸に応答し、特にパルミチン酸(C16:0)やオレイン酸(C18:1)に高い感受性を示します。
- GPR120(FFAR4) は主に不飽和脂肪酸、特にオメガ3系脂肪酸(DHAやEPA)やオレイン酸に親和性が高いとされています。
これらの「受容体」が「脂肪酸」を感知すると
「L細胞」から「GLP-1(グルカゴン様ペプチド-1)」の分泌が誘導されます。
「GLP-1(グルカゴン様ペプチド-1)」の作用と「腸」―「脳軸」
分泌された「GLP-1(グルカゴン様ペプチド-1)」は、
複数の経路を通じて「食欲」や「代謝」に影響します。
- 消化管での作用:胃内容排出を遅らせ、食後血糖の急激な上昇を抑えます。
- 膵臓での作用:膵β細胞を刺激してインスリン分泌を促進し、血糖コントロールを改善します。
- 神経系での作用:腸管に存在する求心性迷走神経終末に作用し、そのシグナルは延髄の孤束核(NTS)に伝達され、さらに視床下部へと送られます。その結果、満腹中枢が活性化し、摂食行動が抑制されます。
「肥満抑制への意義」
この一連の経路、すなわち
長鎖脂肪酸 → GPR40/GPR120 → GLP-1分泌 → 迷走神経/NTS → 視床下部
というシグナルカスケードは、
「腸―脳軸」による「食欲抑制」の重要なメカニズムの一つです。
実際、「GLP-1(グルカゴン様ペプチド-1)」は「糖尿病治療薬(GLP-1受容体作動薬)」
として臨床利用されており、
「血糖改善効果」に加えて「体重減少作用」も確認されています。
これは「食事由来の長鎖脂肪酸」が内因性「GLP-1(グルカゴン様ペプチド-1)」の分泌を促すこと
で、「肥満防御的」に働く可能性を強く示しています。
「長鎖脂肪酸」は単なる「エネルギー源」にとどまらず、
「腸管L細胞」に発現する「GPR40」や「GPR120」を介して「情報分子」として作用します。
この経路を通じて「GLP-1(グルカゴン様ペプチド-1)」が分泌されると
「インスリン分泌促進」、「胃排出遅延」、さらには
「迷走神経」を介した「中枢性食欲抑制」が引き起こされます。
その結果、「食欲」の「コントロール」や「肥満抑制」に寄与し、
「代謝恒常性維持」の一翼を担っているのです。
■「D-プシコース」と「食欲抑制」の仕組み
近年、希少糖として注目される「 D-プシコース(アルロース)」 が、
「血糖コントロール」だけでなく「食欲の抑制」にも関わる可能性が報告されています。
「 D-プシコース(アルロース)」 は
体内で「代謝」されにくく、摂取しても「血糖」をほとんど上げない
「低カロリー甘味料」です。
しかし、その効果は単なる「砂糖の代替」にとどまりません。
「腸」や「腸内細菌」を介して
「ホルモン分泌」や「神経活動」に影響し、「脳」へ「満腹のサイン」を送ることがわかってきています。
「 D-プシコース(アルロース)」 は
「腸管」に存在する「 L細胞」 を刺激して、
GLP-1(グルカゴン様ペプチド-1) の分泌を促します。
「腸内細菌」を介した間接的な効果について
さらに「D-プシコース」は、
「腸内マイクロバイオータ」に作用して 「短鎖脂肪酸」の産生を増やすことが示唆されています。
これらの「短鎖脂肪酸」は「腸」の「L細胞」を刺激して
GLP-1(グルカゴン様ペプチド-1)分泌を高めるため、
「D-プシコース」は
「腸内細菌」を介してGLP-1(グルカゴン様ペプチド-1)を増やす
間接的な経路も持つと考えられます。
分泌されたGLP-1(グルカゴン様ペプチド-1)は、
「腸」に分布する「 求心性迷走神経」 の末端に作用します。
この信号は「延髄」の「孤束核」に伝えられ、さらに「視床下部」へと送られることで
「満腹中枢」を活性化します。結果として、「食欲」が自然に抑えられるのです。
このように、D-プシコースは
直接:「L細胞」を刺激して「GLP-1」分泌を促す
間接:「腸内細菌」→「短鎖脂肪酸」→「GLP-1」増加
という二重のメカニズムを介して、「脳」に「食欲を抑える信号」を届けます。
実際、「GLP-1(グルカゴン様ペプチド-1)」は「糖尿病治療薬」として臨床応用されており、
「体重減少効果」も確認されています。
その意味で、「D-プシコース」は「食品由来」でGLP-1(グルカゴン様ペプチド-1)分泌を高める
「天然の因子」として、「肥満予防」・「改善」に貢献する可能性があるのです。
まとめると、
D-プシコースは単なる「低カロリー甘味料」ではなく、
「腸内細菌」と「ホルモン」・「神経」を介して「食欲」を調整する「機能性成分」として注目されています。
■「腸内代謝物」が「肥満」や「糖尿病」を悪化させる仕組み
近年の研究によって、
「腸内細菌」が産生する「代謝物」が「肥満」や「糖尿病」を悪化させる
重要な因子であることが明らかになっています。
特に「高脂肪食」と 「Firmicutes系細菌(FI菌)」の
関わりが注目されています。
「高脂肪食」を摂ると、消化されなかった「脂質」や「胆汁酸」が「腸」に多く流入し、
「脂質分解」を得意とする「FI菌」が増えます。
すると、「二次胆汁酸」や「酸化脂質」
さらには「腸内」で生成される「トランス脂肪酸(代表的にはエライジン酸)」が増加します。
これらは「腸の上皮細胞」にダメージを与え、「腸のバリア機能」を壊してしまいます。
その結果、
「腸の透過性」が高まり、「内毒素」や「胆汁酸」といった本来「血液」に漏れない「物質」が
全身へと広がる「リーキーガット状態」が起こります。
「血流」に漏れ出した「代謝物」や「内毒素」は「肝臓」に届き、
「炎症反応」を引き起こします。
その過程で「超低密度リポタンパク質」産生が増えて
「血中」の「LDLコレステロール」が高まり、
同時に「炎症性サイトカイン」が分泌され、「インスリン抵抗性」が進行します。
さらに「HDLコレステロール」は減少し、「動脈硬化」のリスクも上昇します。
こうした「脂質代謝異常」と「慢性炎症」が相互に悪循環をつくり出し、
「肥満」や「糖尿病」、「心血管疾患」を悪化させます。
また、
「腸」から漏れ出した「リポ多糖」や「エライジン酸」は「脂肪組織」にも作用します。
「脂肪細胞」には「マクロファージ」が浸潤し、「炎症性物質」を放出することで
慢性的な「炎症状態」が維持されます。
このとき「抗炎症作用」や「インスリン感受性」を高めるホルモンである
「アディポネクチン」は減少し、
逆に「レプチン」の効き目が弱まって「レプチン抵抗性」が進みます。
そのため「食欲抑制」が効かなくなり、
さらに「肥満」が進むという悪循環に陥ります。
つまり、「FI菌」が産生する「代謝物」によって
腸管バリアが破壊され、リーキーガットを介して炎症が全身に広がり、脂肪細胞まで炎症臓器化してしまうことが、肥満や糖尿病を悪化させる大きなメカニズムなのです。






コメント